北京佰司特科技有限责任公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
技术资料/正文
类器官代谢分析仪:实时监测皮肤类器官的细胞层电阻和细胞外酸化率
1128 人阅读发布时间:2024-04-29 17:25
Skin-on-a-Chip:Transepithelial Electrical Resistance And Extracellular Acidification Measurements Through an Automated Air-Liquid Interface
类器官代谢分析仪:微生理系统实时监测细胞层的跨膜电阻值和细胞产酸率
皮肤是人体重要的器官,在保护人体内部器官方面起着至关重要的作用。因此,人们进行了大量的工作来创建人造表皮模型进行体外皮肤毒性试验。这些组织模型被称为重建人表皮细胞模型(reconstructed human epidermis,RhE),被用于在制药、化妆品和环境领域中评估皮肤暴露于外源性物质中的毒性研究。在这里,我们提出了一个无标签的解决方案,它利用了体外诊断智能移动实验室(intelligent mobile lab for in vitro diagnostics,IMOLA-IVD)。一个无创、基于传感器的平台,检测多孔膜上 RhE 细胞模型和贴壁细胞的跨上皮细胞层电阻(transepithelial electrical resistance,TEER)。首先在聚碳酸酯膜上培养小鼠成纤维细胞作为测试模型,使用定制的生物芯片封闭式设计,以及双微流道结构,用于培养物的连续和自动灌流。检测 L929 细胞产酸率(Extracellular acidification rate,EAR)和上皮细胞层的跨膜电阻值(transepithelia lelectrical resistance,TEER)。通过该平台监测 RhE 细胞模型的 TEER 超过 48 小时。TEER 和 EAR 测试表明,该平台可以长时间稳定培养芯片上的皮肤细胞模型,监测代谢参数,以及组织降解。 类器官代谢分析仪:微生理系统实时监测细胞层的跨膜电阻值和细胞产酸率
Keywords:TEER;Organ-on-a-Chip;skin models;reconstructed human epidermis;impedance;label-freemonitoring
1. INTRODUCTION
作为人体最大的器官,皮肤代表着人体内部和外部环境之间的结构学屏障,将体内器官与毒素、病原体隔离开来,并保护内部器官免受紫外线(UV)辐射。除了重要的屏障功能,人体皮肤还执行人体的几个基本功能,如热调节、感觉和排泄。因为皮肤是人类抵御外部环境的影响的第一防护罩,新的化学物质的研究,如药物和毒素,必须分析和评估其对调节皮肤完整性的能力。调查在这些化合物的影响下,细胞生物学利用细胞培养模型,更深入的研究了解由化学物质调节的细胞行为。在过去的十年里,各种生物工程模型被开发用于皮肤毒性研究。第一个皮肤模型基于传统的二维(2D)共培养模型,角质细胞接种到预培养的成纤维细胞上。由于在刚性塑料上培养不能长时间维持上皮细胞,而且阻止了细胞分层,组织工程界开发了 3D 皮肤模型来再现体内类似结构,并通过整合气液界面设计了一个更具有生理相关性的环境。
人的皮肤由下列初级层组成,它们具有附属的功能:表皮层、真皮层和皮下组织。将不同皮肤层整合到细胞模型中,目前的皮肤模型可分为含角质细胞的重建人表皮模型、含角质形成细胞和成纤维细胞的代表真皮和表皮隔层的全层模型,以及带有额外细胞类型(如黑素细胞、干细胞等)的全层模型。由于其结构简化,重新构造人表皮(RhE)模型具有较高的重现性,因而被广泛接受。RhE 细胞模型由人源性角质细胞接种在聚碳酸酯半透膜上,并将其纳入细胞培养系统,置于标准孔板中,如市售 Transwell®系统(Corning Inc.,Corning,NY,USA)。该装置将培养物放置在气液界面,皮肤表面暴露在空气中,形成生理环境类似的培养条件。目前,有开放的皮肤模型,以及商业的模型,如 EpiDerm™(MatTek 体外生命科学实验室,Bratislava,斯洛伐克),EpiSkin™(EpiSkin,Lyon Cedex,法国),SkinEthic™(EpiSkin),EpiCS®(CellSystemsGmbH,Troisdorf,德国),和 LabCyte(日本组织工程有限公司,日本爱知)。ALEXANDRA 协会遵循非营利性和无专利的方法,为制作和测试开放的 3D 皮肤模型提供了方案。
作为人体最大的器官,皮肤代表着人体内部和外部环境之间的结构学屏障,将体内器官与毒素、病原体隔离开来,并保护内部器官免受紫外线(UV)辐射。除了重要的屏障功能,人体皮肤还执行人体的几个基本功能,如热调节、感觉和排泄。因为皮肤是人类抵御外部环境的影响的第一防护罩,新的化学物质的研究,如药物和毒素,必须分析和评估其对调节皮肤完整性的能力。调查在这些化合物的影响下,细胞生物学利用细胞培养模型,更深入的研究了解由化学物质调节的细胞行为。在过去的十年里,各种生物工程模型被开发用于皮肤毒性研究。第一个皮肤模型基于传统的二维(2D)共培养模型,角质细胞接种到预培养的成纤维细胞上。由于在刚性塑料上培养不能长时间维持上皮细胞,而且阻止了细胞分层,组织工程界开发了 3D 皮肤模型来再现体内类似结构,并通过整合气液界面设计了一个更具有生理相关性的环境。
人的皮肤由下列初级层组成,它们具有附属的功能:表皮层、真皮层和皮下组织。将不同皮肤层整合到细胞模型中,目前的皮肤模型可分为含角质细胞的重建人表皮模型、含角质形成细胞和成纤维细胞的代表真皮和表皮隔层的全层模型,以及带有额外细胞类型(如黑素细胞、干细胞等)的全层模型。由于其结构简化,重新构造人表皮(RhE)模型具有较高的重现性,因而被广泛接受。RhE 细胞模型由人源性角质细胞接种在聚碳酸酯半透膜上,并将其纳入细胞培养系统,置于标准孔板中,如市售 Transwell®系统(Corning Inc.,Corning,NY,USA)。该装置将培养物放置在气液界面,皮肤表面暴露在空气中,形成生理环境类似的培养条件。目前,有开放的皮肤模型,以及商业的模型,如 EpiDerm™(MatTek 体外生命科学实验室,Bratislava,斯洛伐克),EpiSkin™(EpiSkin,Lyon Cedex,法国),SkinEthic™(EpiSkin),EpiCS®(CellSystemsGmbH,Troisdorf,德国),和 LabCyte(日本组织工程有限公司,日本爱知)。ALEXANDRA 协会遵循非营利性和无专利的方法,为制作和测试开放的 3D 皮肤模型提供了方案。
2. Background
2.1. 基于重构人表皮的皮肤毒性试验的最新进展
从监管角度来看,评价和预测有毒化合物和药物对皮肤的有害影响,3D 模型系统必须经过一系列广泛测试化合物的验证。如果通过欧洲替代方法验证中心(ECVAM)证实和经济合作与发展组织(OECD)测试指南(TG),具有指定测试技术的模型就可以作为可接受的工具用于皮肤毒性测试。到目前为止,OECD 提供了用于皮肤腐蚀和刺激的指南测试的指南,分别基于 OECD TG 431 和 439。
2.2. 器官芯片平台和微生理测量
由于目前的模型在生物学的相关性上,只提供有限的意义,所以毒理学领域测试正朝着实现器官芯片(Organ-on-Chip,OOC)仪器的方向发展。器官芯片系统描述了一种包含灌注室的微流体细胞培养装置,在生理相关条件下培养活细胞。然而,大多数 OOC 平台仍然严重依赖端点分析方法,缺乏的不同时间点的测试方法。此外,化学标签,如荧光标签可能会潜在地影响细胞代谢从而改变实验结果。因此,采用无标签技术的实时读数的集成设备,对于测量进行空间和时间解析的是非常有意义的。
2.3. 皮肤/重建人表皮的细胞层的跨膜电阻值
由于潜在的有害化合物会影响皮肤厚度,厚度的测量也是早期研究的参数之一。破坏性测量,例如活组织检查,或非破坏性测量,如共焦拉曼光谱仪和超声波成像。其中最传统的方法和有用的细胞培养的应用就是测量皮肤通透性屏障,以评估上皮或内皮组织的活力和功能。在这里,细胞层的跨膜电阻值(TEER)提供了一种无标记和快速的技术来研究皮肤完整性。TEER 值测量了一个或几个细胞层的电阻。
2.4. 目前上皮细胞层的跨膜电阻值测量的缺点和跨上皮细胞层电阻自动化测量的需要
除了微加工方法,还有一些商业上可用的外部测试系统,如「伏特-欧姆计」(World Precision Instruments, Sarasota, FL, USA),,它可以现成的。由于缺少与细胞培养系统的整合,研究人员需要手动将细胞培养物从生物培养箱放到测量系统。这个过程缺乏重现性和标准化,也不能提供高通量测量的能力。虽然下一代的电极室(如 Endohm 室)可以直接测量,但是培养基以及试剂都必须手动加入,用于长期培养和药物研究案例。因此,扩展的研究是不可能的,因为旧的介质不能从培养系统中取出,也没有自动灌注新鲜的培养基。总而言之,目前的 TEER 测量系统仍然严重依赖手动操作和手持式系统,影响了测量的稳定性,从而影响了整体实验的再现性。经济合作与发展组织(OECD)认为,一个可接受的测试方案,分析重现性是验证中的一个基本标准。因此,TEER 领域通过集成自动 TEER 监控和采集,系统能够在培养基频繁变化的情况下执行编程测试模式测量,也可以大大受益。
在此,我们介绍了一种新的自动监测测试系统和采集系统用于 TEER 测量,the intelligent mobile lab for in vitro diagnostics(IMOLA-IVD)(cellasys GmbH, Kronburg, Germany)。开发了一个密封设计的商业化,用聚碳酸酯膜培养的表皮细胞 RhE 细胞模型。应用 TEER 测量用于研究 RhE 培养,并集成到自动化的流体平台,可以精确灌注培养基和加药。此外,我们能够监测细胞产酸率(extracellular acidification rate, EAR)。实证研究的目的是通过集成自动化灌流系统和集成测试平台,实现实时动力学测量,同时保证测量稳定性。本研究演示了一种评估皮肤完整性的无创的测量方法的验证和应用。
3.Materials and Methods
3.1. 体外诊断智能移动实验室概述
IMOLA-IVD 是一种芯片上的实验室测量系统,用于自动监测 L929 小鼠成纤维细胞和 EpiDerm™重建人表皮细胞模型的 TEER 和 EAR。IMOLA-IVD 的基本操作已经在之前的工作中进行了描述,简单地说,每个 IMOLA-IVD 包括一个电源、模拟和数字模块,以及一个集成了传感器的生物芯片,该传感器被动地监测细胞模型的微环境。标准的 IMOLA-IVD 实验是通过装载数据采集和链接应用(DALiA)客户端 2.0 软件的个人计算机实现自动化的,以控制一个蠕动泵和连接 6 个 IMOLA-IVD 系统的微流控网络。泵在 ON 和 OFF 状态之间循环。在 OFF 泵关闭周期,细胞能够代谢培养基中的营养物质;在 ON 泵开发周期,营养丰富的培养基被灌流到细胞中。
3.2 改进的 BioChip-D 小室
生物芯片模块包含一个传感器芯片连接到电路板并连接到一个圆柱形密封小室,用以保护芯片的连接并连通细胞及培养基。一个流体头直接连接密封小室,形成一个液体密封、静态微容积(~ 6μL)的反应室,在集成的传感器表面测量细胞产酸率(EAR)和氧合作用(图 1a)。然而,需要测量 RhE 的情况下,多孔膜上培养的细胞不适合标准生物芯片或标准的 IMOLA-IVD 叉指电极传感器(IDES)测量阻抗。为了克服这些限制,新的密封小室和流体头的设计,以保持空气-液体使用 Pro/Engineer Wildfire 4.0(PTC Inc., Needham, MA, USA)。封装用 Ultimaker 2(Ultimaker BV,Geldermalsen,Netherlands),使用聚乳酸(PLA)和硅橡胶医用粘合剂(Corning Inc., New York, NY, USA)连接到生物芯片 BioChip。重新设计的 BioChip 小室适用于扩大培养室和其他多孔膜上培养的细胞(图 1b)的 RhE。
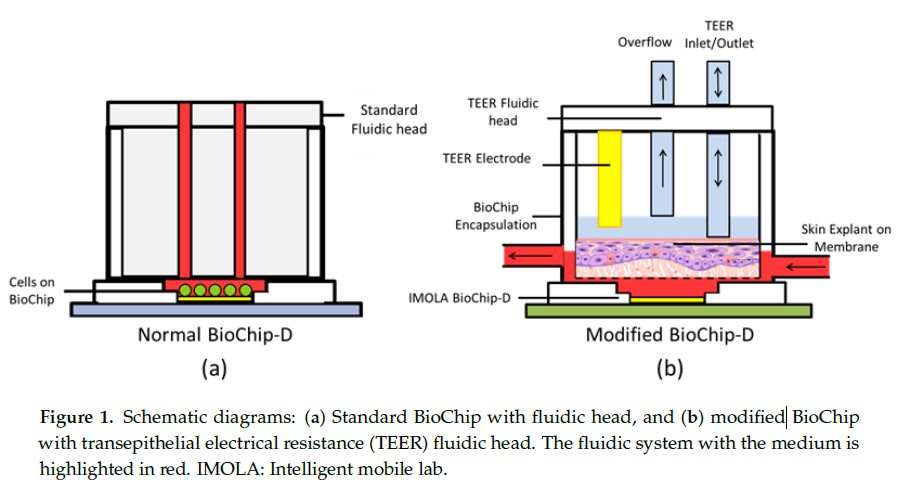
3.3. L929 细胞与重建人表皮细胞的制备与培养
记录小鼠成纤维细胞(L929)和重建人表皮细胞(RhE)的跨上皮细胞层电阻值。L929 细胞在加 10% 胎牛血清(FBS)和 10 μg/ml gentamycin(Thermo Fisher,Waltham, MA, USA)。细胞按照标准的实验室规范(GLP)培养,并保存于 37℃ 和 5% 的培养箱中培养后,在 95% 融合度时,细胞传代,100,000 细胞种在 12 mm Transwell®上,孔径 3 μm 的多孔膜(Corning In)。transwell 随后被放置在 6 孔板上,并在 1 ml DMEM 中再孵育 24 小时,然后转移到 modified BioChips 中。
L929 细胞是我们实验室的标准细胞系,用于验证实验。将 EpiDerm™RhE 细胞模型转移到 6 孔板上,并在 5.5 mm/5 mL 的 MatTek 无血清长期培养基(#EPI-100-NMM-250)(MatTek 体外寿命科学实验室)。每 48 小时交换一次培养基,直到转移到 BioChips 中对三通实验。实验开始前 24 h,将培养基减少到 0.9 mL 然后放在 12 个盘子里。Modified BioChip-D 在 70% 乙醇中室温灭菌处理 20 min 后,用无菌去离子水冲洗。生物芯片灌注无缓冲 DMEM 处理 24 h 以稳定温度,然后将膜培养物放置在芯片上。
3.4. 自动化灌流系统的介绍
设计了一种自动灌流系统来自动化监测在生物芯片上培养 48 小时以上的 RhE 细胞模型的 TEER。该系统由两个流体模块(FM)组成,通过与 Tygon® E-3603(ProLiquid GmbH, Ueberlingen, Germany)管道连接成独立的管道。这些独立的网络通过 IMOLA-IVD 泵标准设置的 ON/OFF 开关程序,向基底细胞提供营养丰富的细胞培养基,并定期向 Transwell®膜的顶部区域,泵入磷酸盐缓冲盐溶液(PBS)。如图 2 所示。介质传输模块在无缓冲的 DMEM 和 0.2%SDS 的培养基之间切换,提供给膜底部的细胞。TEER 测量模块连接到 PBS 进行 TEER 测量或测试可用于接种 RhE 表面的水溶性测试物。
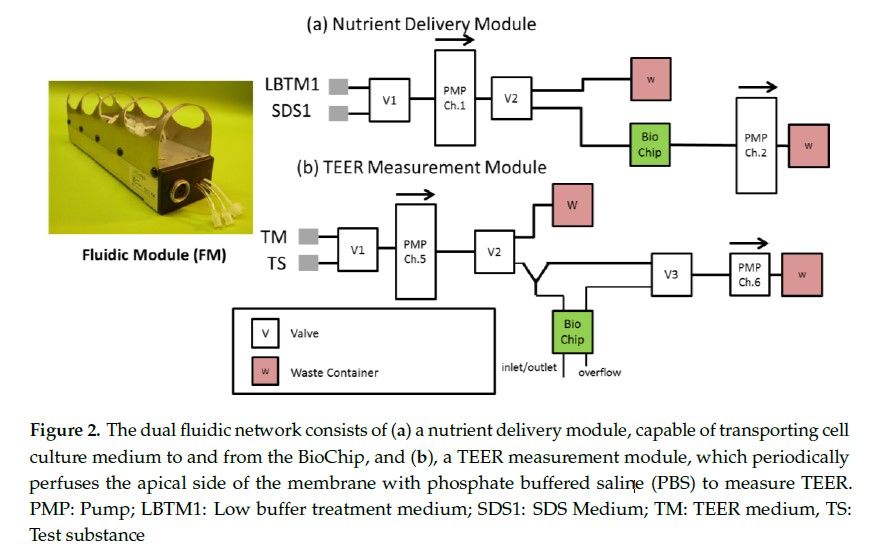
L929 细胞培养在多孔膜小室上,RhE 细胞模型培养在 Modified BioChip-D 上,通过无缓冲的 DMEM 与灌流泵进行 36 小时周期的培养。对于 L929 细胞,为监测细胞酸化,泵 ON 时间为 5 分钟,而泵 OFF 时间为 5 分钟、10 分钟、30 分钟和 55 分钟。对于 RhE 细胞模型,泵时间为 5 分钟 ON, 10 分钟 OFF, 5 分钟 ON, 25 分钟 OFF, 5 分钟 ON, 10 分钟 OFF。在 25 分钟的泵 OFF 阶段,通过将 PBS 泵入膜顶部小室,在芯片上的阻抗传感器和流体头部的导线电极之间建立电路连接,记录 TEER 测量。以 60 μL/min 的速度将 750 μL 的 PBS 泵到芯片上的膜上,然后以 120μL/min 的速度去除。TEER 测量是在 25 分钟泵关闭期间进行的。在预定的稳定测量周期后(L929 细胞和 RhE 细胞模型分别为 47 和 36 小时),将 0.2% SDS 无缓冲 DMEM 泵入芯片作为阳性对照。用 SDS 培养基灌注至少 12 小时,以证实对照组对测得的 TEER 的影响。
4. Results and Discussion
4.1. 重新设计的经上皮电阻封装功能
将多孔膜插入培养室,确定培养室体积为 ~170 μL。介质通过膜下形成的入口孔灌注到腔内,膜底部的孔允许新鲜营养物质被动地扩散到细胞的基底层和细胞的废物扩散出细胞。在泵 ON 循环期间,营养消耗后的培养基泵出腔室(图 2)。RhE 培养物的顶端表面暴露于环境空气中,经过长时间的培养,刺激分化成一个 ALI 的分层。为了测量这些培养物的 TEER,重新设计的流体头包含一个双向入口/出口阀,周期性地分配一定量的 PBS 溶液。这种解决方案连接多孔膜顶端腔的导线电极(见图 1b)和传感器芯片上的平面 IDES 电极之间的电路。溢流阀使 TEER 电极淹没在稳定的介质体积中,防止溢流。连续 5 分钟记录膜的 TEER,然后在测量之后取出 PBS 以维持 ALI。
4.2. 小鼠成纤维细胞的胞产酸率的测定
使用自动测量协议监测 EAR,将 L929 细胞生长在聚碳酸酯膜。用未缓冲的 DMEM 以 50 μL/min 的速率灌注 L929 细胞。图 3 显示了在泵交替阶段测量的 pH 值(以 mV 为单位)。红色条表示泵 OFF 阶段,灌流新鲜培养基,细胞活跃地将营养物质代谢为酸性废物,生物芯片上的金属氧化物传感器会检测到这些代谢物。绿色条表示泵 ON 阶段。在此阶段中,膜底部灌注新鲜培养基,提供营养给膜上培养的细胞。从图中可以看出,当介质酸化时,泵 OFF55 分钟时,电压会增加 ~5 mV,而较短的时间内不会产生明显的电压变化。
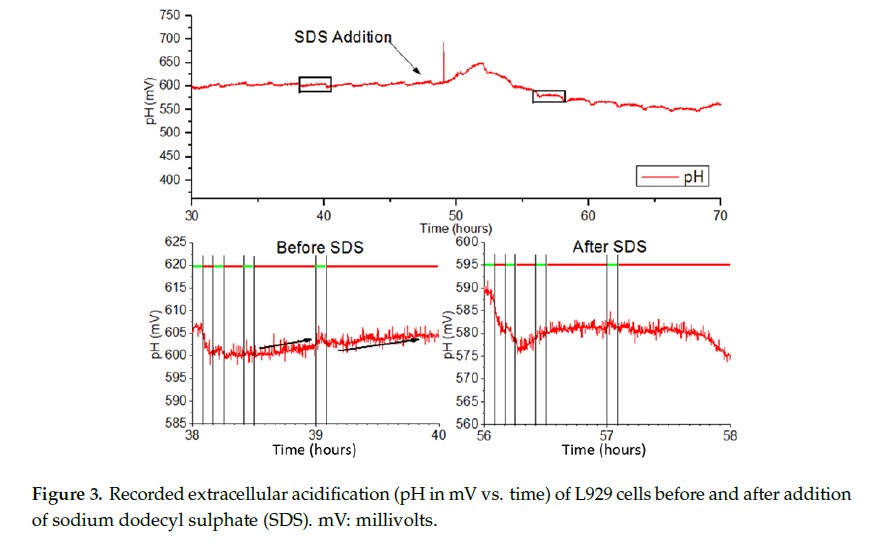
4.3. 小鼠成纤维细胞对十二烷基硫酸钠培养基的代谢反应
一旦泵 ON 周期结束,测量的电压迅速下降,直到达到基线(稳态)值。在下降之前存在一个短暂的延迟,这可能是由于新鲜培养基与芯片上已有的酸化培养基之间的混合导致的,因为出口的位置高于进口。在 58 小时,测量的信号下降。这可能是由于细胞膜破裂和细胞内内容物释放到培养基中。在 56 小时,细胞已经溶解,因此不会产生废物酸化周围的介质,导致在 55 分钟泵 OFF 阶段信号变平坦。图 4 描述了在实验持续时间 55 分钟 OFF 阶段持续测量 EAR。可以看出,加入 SDS 后,EAR 突增,然后迅速降至零以下,表明细胞裂解。然后它逐渐趋近于零,直到实验结束。
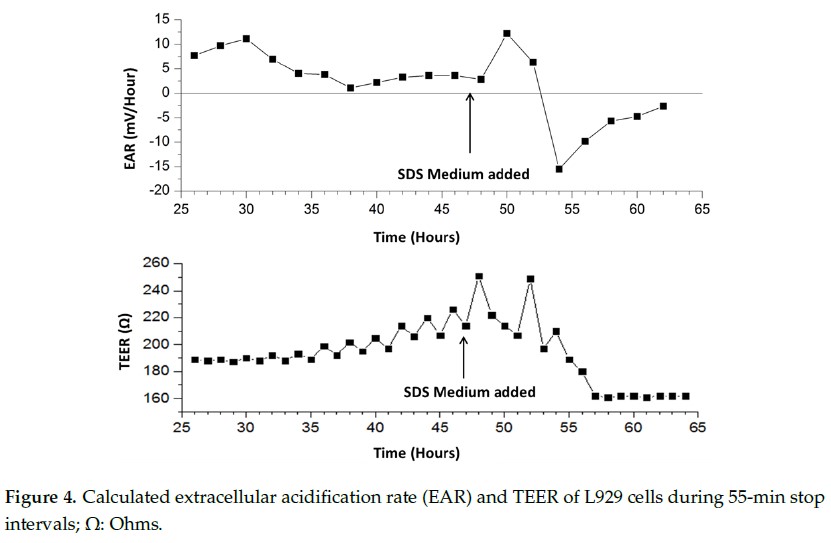
4.3. 小鼠成纤维细胞对十二烷基硫酸钠培养基的代谢反应
一旦泵 ON 周期结束,测量的电压迅速下降,直到达到基线(稳态)值。在下降之前存在一个短暂的延迟,这可能是由于新鲜培养基与芯片上已有的酸化培养基之间的混合导致的,因为出口的位置高于进口。在 58 小时,测量的信号下降。这可能是由于细胞膜破裂和细胞内内容物释放到培养基中。在 56 小时,细胞已经溶解,因此不会产生废物酸化周围的介质,导致在 55 分钟泵 OFF 阶段信号变平坦。
图 4 描述了在实验持续时间 55 分钟 OFF 阶段持续测量 EAR。可以看出,加入 SDS 后,EAR 突增,然后迅速降至零以下,表明细胞裂解。然后它逐渐趋近于零,直到实验结束。

4.4. RhE 细胞模型的 TEER(上皮细胞层的跨膜电阻值)监测
使用上述相同的设置对重建人表皮细胞模型(reconstructed human epidermis,RhE)进行连续监测 TEER 约 50 小时。在前 12 小时,TEER 值保持相对稳定,如图 5 所示。在 36 小时后,用 0.2% SDS 处理细胞后 2 小时,平均 TEER 值突然下降。SDS 培养基加入前,TEER 值最初是尖峰的,在用 PBS 加入顶端腔后,然后迅速稳定并保持,直到 5 分钟的测量周期结束。当从上部小室中移除培养基后,由于电路短路,TEER 再次变成无数值。
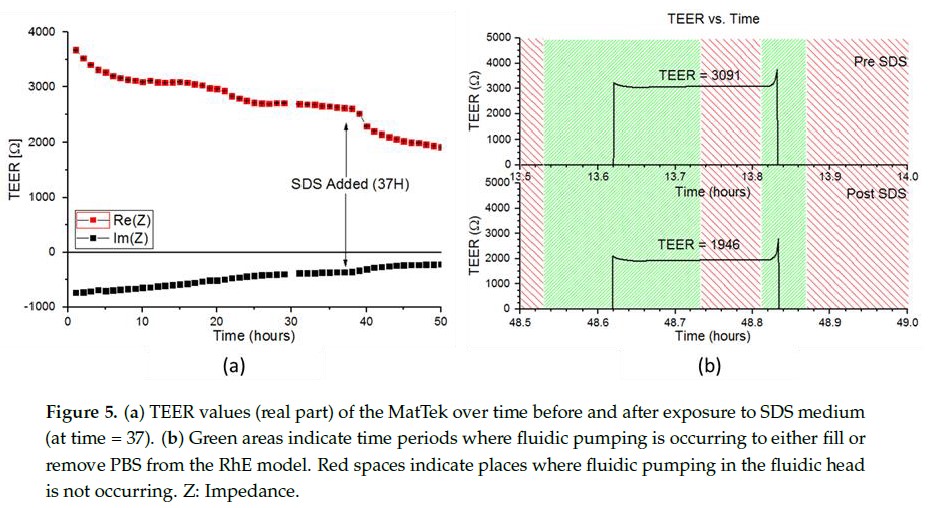
在换到 SDS 培养基 2 小时后,TEER 曲线的变化就可以被检测到。起初,TEER 值与接种 SDS 培养基前相同。但是 TEER 值在测量期间稳步下降,直到稳定在一个更低的值。这导致测得的平均 TEER 降低,这与添加 SDS 引起的细胞裂解相对应。此外,随着 SDS 培养基加入时间的增加,阻抗的初始峰幅值减小。尽管暴露于 SDS,最初的峰值的持续似乎表明细胞存活。值得注意的是,以前的 IMOLA-IVD 研究是在简单的单层细胞上进行的,相对较低浓度的 0.2% SDS 就可以较短的时间内完全杀死细胞。而正是严重细胞的缓慢裂解可能归因于更复杂的 3D 皮肤模型中培养的细胞的生命活力的增强。
5. Conclusions
在这里,我们提出了一种创新的方法,以非侵入性监测细胞培养在二维和三维多孔膜在各种形态。我们最先进的生物芯片密封设计被证明支持小鼠成纤维细胞的单层,以及更复杂的重建人表皮细胞模型(reconstructed human epidermis,RhE)。此外,设计了一个两部分的自动化流体系统,处理将 PBS 溶液输送和加入到顶部腔室进行 TEER 测量。使用 L929 细胞,设计了一个标准的操作方法,通过定期测量 TEER 来监测代谢率和屏障完整性。SDS 培养基加入之前保持的细胞活力,作为阳性对照。
在用 L929 细胞进行初步试验后,对重建人表皮细胞模型的 TEER 进行监测。TEER 值显示皮肤模型可以培养至少 24 小时,加入 SDS 培养基后的细胞裂解也会延迟。在以后的实验中可以使用更高的 SDS 浓度来提高对照的响应时间。总的来说,这项工作是一项概念验证实验,证明了 IMOLA-IVD 用于复杂 3D 组织模型的能力,作为非侵入式自动化细胞分析的工具。值得注意的是,这项工作还提出了一个维持 ALI 的自动 TEER 测量的方法。






