北京佰司特科技有限责任公司
8 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
技术资料/正文
年轻人体血清中的系统性因素影响微生理共培养系统中人体皮肤和骨髓源性细胞的体外反应
33 人阅读发布时间:2025-12-26 19:20
年轻人体血清中的系统性因素影响微生理共培养系统中人体皮肤和骨髓源性细胞的体外反应

Systemic factors in young human serum influence in vitro responses of human skin and bone marrow-derived blood cells in a microphysiological co-culture system
Johanna Ritter, Cassandra Falckenhayn, Minyue Qi, Leonie Gather, Daniel Gutjahr, Johannes Schmidt, Stefan Simm, Stefan Kalkhof, Janosch Hildebrand, Thomas Bosch, Marc Winnefeld, Elke Grönniger, Annette Siracusa
Beiersdorf AG, Research and Development, Hamburg, Germany
Institute for Bioanalytics, Coburg University of Applied Sciences and Arts, Coburg, Germany
Proteomics Unit, Department Preclinical Development and Validation, Fraunhofer Institute for Cell Therapy and Immunology, Leipzig, Germany
4Zoological Institute, Kiel University, Kiel, Germany
摘要
衰老是一个复杂的生物学过程,其不仅显著加速年龄相关疾病的发生,更对有效干预措施构成重大挑战,目前鲜有系统性抗衰老方案能成功逆转衰老表征。异时共生实验揭示了血液因子可能具备 rejuvenation (抗衰延寿,返老还童)潜能,然而其关键驱动因子及潜在作用机制迄今仍未阐明,相关发现尚未成功转化至人体研究。本研究通过构建包含3D皮肤与3D骨髓的串联芯片共培养的微生理系统,首次实现了利用系统性因子使人皮肤重现年轻化特征。与衰老人体血清相比,年轻人体血清的引入显著提升了表皮细胞增殖能力,并基于甲基化衰老时钟检测证实皮肤生物学年龄的降低。值得注意的是,该效应仅在骨髓源性细胞存在条件下显现。对骨髓模型的深入分析揭示了年轻与衰老人体血清处理引发的细胞群体动态变化。通过蛋白质组学分析,我们鉴定出55种由骨髓源性细胞分泌的潜在系统性 rejuvenation 蛋白,其中7种经衰老标志物检测验证可显著促进人体皮肤细胞年轻化,确证了这些蛋白作为 rejuvenation 系统性因子对皮肤的调控作用。
介绍
衰老与功能性组织的渐进性衰退密切相关,这种衰退会导致成年期疾病易感性和死亡风险上升。随着人口预期寿命的延长,探究衰老机制以促进健康老龄化和延长无病寿命已成为重要研究课题。作为人体最大的器官,皮肤因其衰老迹象最早显现且能反映整体健康状况,成为研究衰老过程的理想组织模型。
迄今为止,仅有少数方法被证实能够通过同步逆转多种衰老特征来实现组织的整体年轻化。其中,异种共生技术通过连接不同年龄动物的血液循环系统,展现出独特的优势。暴露于幼体循环系统下的老年小鼠表现出组织年轻化迹象,即器官与组织的功能及细胞活性均得到改善。此外,将幼猪血浆外泌体组分通过静脉注射至老年大鼠体内后,其血液、心脏和肝脏的表观遗传年龄显著降低[3]。就皮肤而言,研究证实异种共生可改善组织结构、减少衰老细胞并改变基因表达模式。与其他器官不同,全身性年轻化干预措施对皮肤生物学年龄的影响尚未得到充分研究。表观遗传改变作为可逆的衰老核心标志,基于DNA甲基化的年龄时钟已被广泛认可为评估衰老与年轻化的多组织生物标志物。表观遗传年龄时钟是精密的计算模型,通过分析DNA甲基化模式来准确估算个体或器官的生物学及功能年龄。这些模型基于皮肤、血液等不同组织的DNA甲基化数据,经跨年龄段训练后能够可靠预测未知样本的生物学年龄。近期一项人体I期临床研究表明,老年受试者经肌肉注射脐带血浆浓缩物后,血液生物学年龄降低且生物标志物改善,首次证实人体也可能出现全身性因子介导的年轻化现象[9]。然而,除血液外,全身性因子如何影响皮肤等其他人体器官仍属未知。此外,目前仅发现少数系统性衰老及年轻化的特异性驱动因子及其作用机制。例如,异种共生实验鉴定出金属蛋白酶组织抑制因子2(TIMP-2)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、生长分化因子11(GDF-11)和血小板反应蛋白4(THBS4)等因子,它们与富含半胱氨酸的分泌型酸性蛋白样1(SPARCL1)共同改善肌肉和大脑的年龄相关性退行性病变。特别值得注意的是,GDF-11在体外及离体实验中显示出促进人皮肤中原胶原蛋白1和透明质酸合成、加速细胞增殖及改变基因表达等年轻化效应。但除THBS4、SPARCL1和GDF-11外,目前发现的大多数因子仅在啮齿类动物模型中得到验证,这很可能源于动物模型研究成果向人体细胞培养系统转化时面临的挑战。
微生理系统(Microphysiological Systems,MPS),亦称器官芯片平台,通过采用多种人体细胞类型组成的类器官及整合模拟血液循环的循环培养基流,为研究人体生物过程和重现体内特定微环境要素提供了创新方法。首SHOU个用于鉴定鼠类肌肉年轻化因子的工程化MPS系统已被报道,该系统可在体外部分模拟联体共生现象,但针对人体衰老研究的系统仍属空白。
本研究采用MPS技术将异时联体共生实验的年轻化策略转化为体外细胞培养体系,旨在系统性探究人体皮肤衰老与再生机制,并阐明驱动皮肤年龄相关变化的分子机理。除系统因子外,血液还含有源自骨髓(BM)微环境的细胞组分。骨髓包含异质性细胞群,涵盖造血干细胞(HSCs)、间充质干细胞(MSCs)及各系定向祖细胞。HSCs通过严格调控的自我更新与分化过程,负责终身维持所有血细胞谱系的生成。已知骨髓源性细胞易受微环境影响,并能响应血液循环分泌细胞因子、生长因子和趋化因子等关键分子,这些分子在造血调控、免疫应答和组织修复中发挥核心作用。研究表明HSCs及所有骨髓源性免疫细胞连同其生物活性分泌组,均显著影响皮肤生理功能——骨髓干细胞可向创伤与非创伤皮肤区域迁移,对皮肤再生、修复及稳态维持具有决定性作用。
骨髓微环境的衰老相关改变已被广泛研究,其特征表现为HSCs自我更新能力与功能衰退、微环境改变(包括MSCs功能受损)、淋巴样细胞群体减少、炎症衰老及表观遗传变异。衰老骨髓源性细胞促炎细胞因子的累积会加速皮肤衰老进程,而功能受损的HSCs无法有效促进伤口愈合,导致衰老皮肤再生能力下降及屏障完整性减弱。为此,我们决定在多器官串联芯片系统中将全层皮肤模型与成熟骨髓模型进行串联培养。在成功建立串联共培养体系后,向系统注入年轻与年长供体的人体血清以模拟异时联体共生实验效应。研究证实:年轻人体血清可改变骨髓分化模式,并改善皮肤的生物学年龄、形态学特征及细胞增殖能力。值得注意的是,这些效应仅在两个类器官串联共培养系统中显现,这既印证了循环细胞作为系统器官相互作用的介质的关键作用,也突显多器官串联芯片系统作为研究系统年轻化的技术前提。皮肤年轻化效应实质上是骨髓响应年轻循环血液因子所分泌多种因子的协同结果。通过对比年轻与老年血清处理的骨髓模型,我们鉴定出55种年龄相关蛋白,其中部分蛋白经体外实验验证可改善人体皮肤细胞的衰老标志物。本研究首次为系统因子对人体皮肤的年轻化效应提供实证依据,并确定七种蛋白在皮肤年轻化进程中发挥核心驱动作用。
结果
Young human serum alone does not improve aging markers of human skin models仅凭年轻人体血清无法改善皮肤模型的衰老标志物
基于异时共生实验的研究结果,我们提出假说:向人体皮肤模型添加年轻人体(年龄<30岁)或老年人体(年龄>60岁)的血清,应能分别使组织年轻化或加速衰老。
为验证该假说,我们采用含10%年轻(10名30岁以下供体混合)或老年(10名60岁以上供体混合)血清的Phenion®全层插入式皮肤模型进行静态培养(图1A)。首先通过分析真皮层衰老相关基因(如DPT、DCN、THBS1和EZH2,见附表1)的表达谱进行比较。然而,年轻人体血清培养组与老年人体血清培养组的基因表达谱未呈现显著差异(图1B)。
随后在组织学层面评估血清对皮肤模型的影响,通过Ki67阳性细胞比例检测增殖能力。该再生能力作为重要衰老标志物,既往研究证实其随皮肤老化显著降低。但年轻与老年血清培养组间仍无统计学差异(图1C)。
为排除培养周期不足可能导致的阴性结果,我们将培养时间从7天延长至21天,并通过微生理系统(MPS)多器官串联芯片系统进行动态培养。运用TissUse公司的HUMIMIC Chip3plus三器官芯片模拟微流道流体剪切力的生理环境以延长培养周期[24]。此方案中,Phenion®全层长周期插入式皮肤模型采用10%年轻或老年血清培养(图1D)。三周动态培养后,采用相同基因组合进行表达谱分析,仍未发现两组间存在显著差异(图1E)。Ki67免疫荧光染色结果同样无统计学差异(图1F)。最后采用自主研发的皮肤年龄时钟[7]与经典血液年龄时钟[8]评估皮肤生物学年龄,仍未检测到显著变化(图1G)。
综上,本研究未能证实年轻人体系统性因子对人体皮肤具有直接年轻化效应。
Establishment of a dynamic co-cultivation of skin model and BM model皮肤模型与骨髓模型的动态共培养体系建立
鉴于所有源自骨髓的细胞均会随全身性因子共同循环至人体各组织并分泌可到达所有组织的分子,我们旨在重构该微环境以实现更精准的全身衰老研究。为此,我们在HUMIMIC Chip3plus三器官芯片系统中构建了包含多种髓系免疫细胞的骨髓模型与皮肤模型的串联共培养体系。
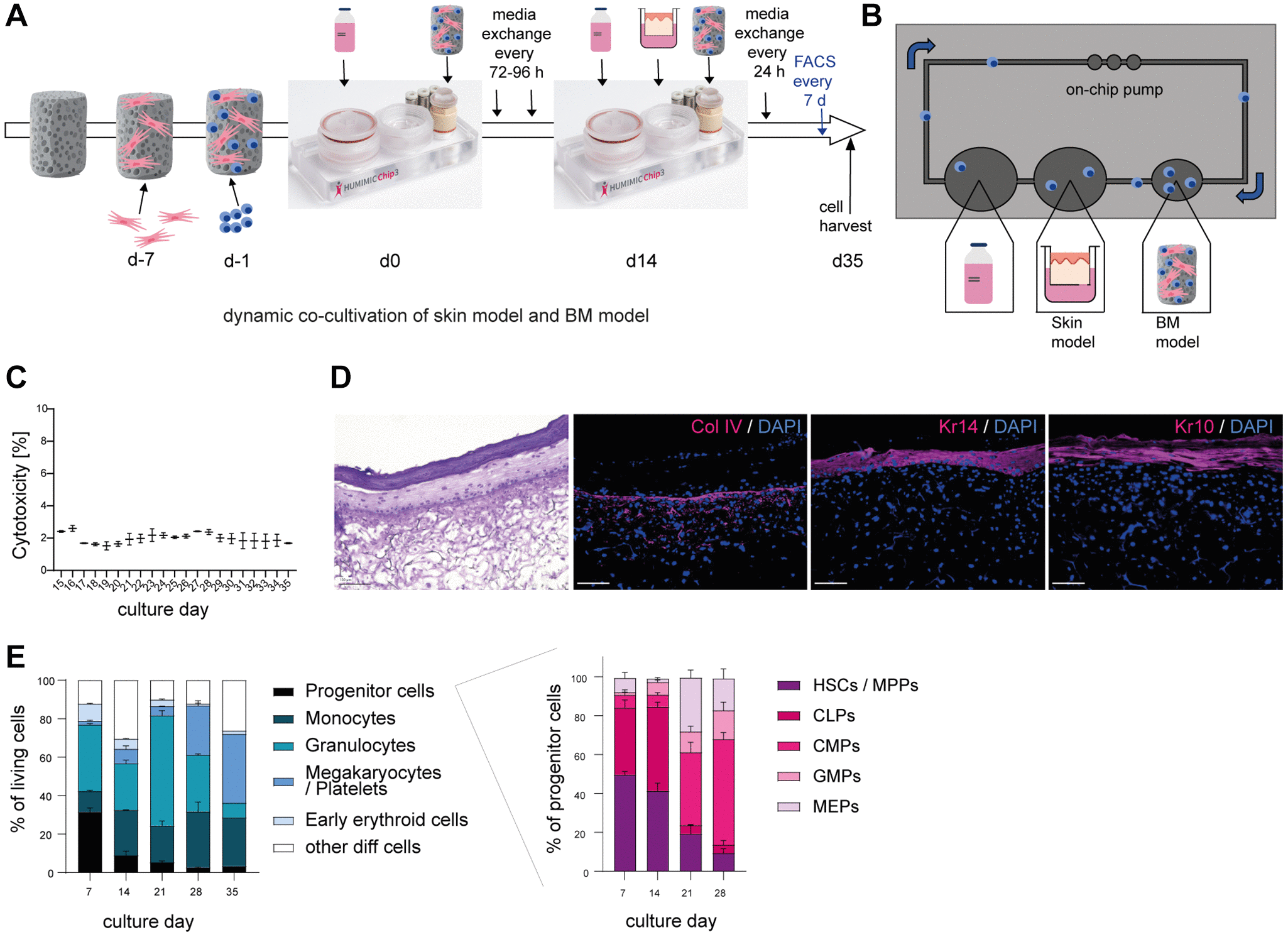
动态骨髓模型的建立基于Sieber团队首创方法并进行了微调:将人骨髓间充质干细胞接种于羟基磷灰石包被的氧化锆基Sponceram®载体,培育形成类人骨髓微环境。随后在该支架上加入人骨髓CD34+细胞,于HUMIMIC Chip3plus三器官芯片内诱导分化为髓系细胞。两周后启动与Phenion®全层长周期插入式皮肤模型的串联共培养,持续21天(图2A)。该动态串联共培养体系通过芯片的微流泵与微流控技术实现培养基持续循环流动,促进骨髓源血细胞再循环及皮肤-骨髓间分泌因子的双向交换(图2B)。通过检测乳酸脱氢酶释放量计算细胞毒性,证实串联共培养全程保持活力(细胞毒性低于5%,图2C)。使用添加生长因子的SFEM II培养基时能维持细胞活力,其他培养基会导致显著活力丧失与分化能力下降(附图1)。苏SU木MU精-伊红染色证实共培养21天期间皮肤模型结构完整,包含真皮、表皮及角质层(图2D)。
针对三种关键皮肤结构与分化标志物(IV型胶原、角蛋白14及角蛋白10)的染色显示基底膜发育良好,并验证了培养全程存在早期(Kr14)与晚期(Kr10)角质形成细胞分化(图2D)。流式细胞术分析35天培养周期内骨髓细胞组成(图2E及附图2):培养7天后,祖细胞占群体25%,同时出现单核细胞、粒细胞、早期红系细胞及少量巨核细胞与血小板。随时间推移,祖细胞比例下降而单核/粒细胞增加,早期红系细胞减少,巨核细胞与血小板增多。由此可见,所建骨髓模型中存在全部髓系细胞且各群体在培养全程均可检出。其中造血干细胞、多能祖细胞及共同淋巴样祖细胞逐渐减少,而共同髓样祖细胞、粒-单祖细胞与巨核-红系祖细胞于后期(培养21天后)成为主体(图2E右)。
综上,我们成功构建了皮肤模型与骨髓模型(含髓系免疫细胞及多种祖细胞群体)的共培养体系,并维持长达21天的培养周期。
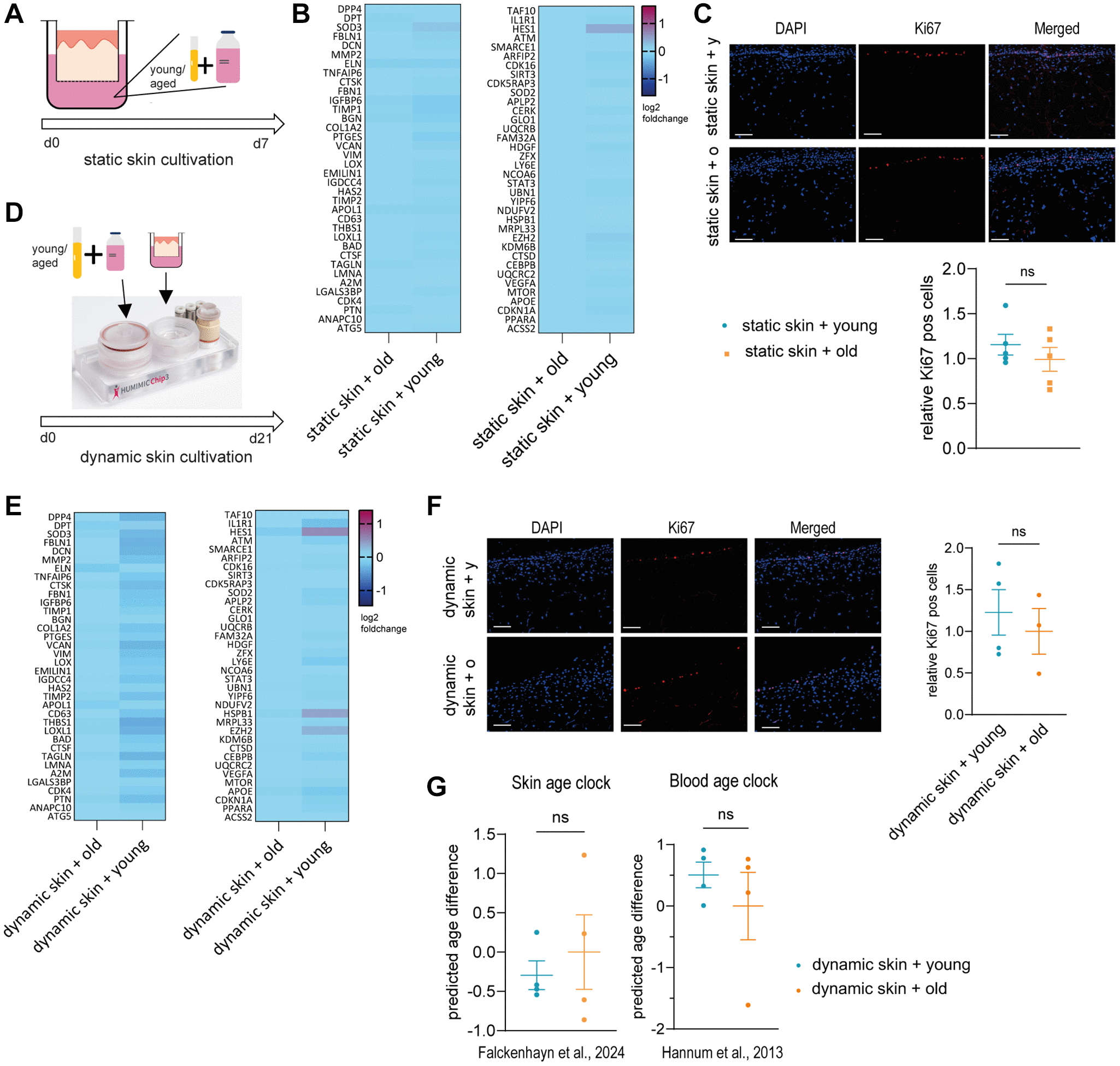
Figure 1. Young or old human serum alone does not have an effect on 3D skin models in static or dynamic culture. (A–C) 无论是静态培养还是动态培养条件下,年轻或老年人体源血清单独作用均未对三维皮肤模型产生显著影响。(A-C)
采用(A)图示方案,将人源三维皮肤模型(Phenion®)分别与年轻供体(<30岁)及年长供体(>60岁)血清进行为期7天的静态共培养。(B)热图显示经年长与年轻血清处理的皮肤模型相对基因表达谱,数据均以年长血清处理组为基准进行归一化。(C)通过Ki67免疫荧光染色(红色)分析处理组皮肤模型冷冻切片,上图为代表性图像(比例尺=100µm),柱状图显示以年长血清处理组为基准的Ki67阳性细胞相对比例。(D-F)采用HUMIMIC Chip3plus系统,按照(D)图示方案将人源长寿命三维皮肤模型(Phenion®)与不同年龄血清进行为期21天的动态共培养。(E)热图呈现动态培养条件下年长与年轻血清处理组的相对基因表达差异,数据以年长血清对照组为基准归一化。(F)动态培养三维皮肤模型的Ki67免疫荧光染色(红色)对比结果,柱状图显示以年长血清处理组为基准的Ki67阳性细胞相对比例。(G)基于皮肤DNA甲基化时钟[7]与血液年龄时钟[8]的生物年龄测定结果,数据以年长血清处理组为基准归一化。所有数据均表示为均值±SEM(单次实验,3-5次重复),采用非配对t检验,ns表示p>0.05。(D)中HUMIMIC Chip3plus三器官芯片图像版权归属TissUse GmbH,遵循CC BY ND 4.0许可协议。
Figure 2. Successful co-cultivation of skin model and BM model in a long term dynamic in vitro MPS. 皮肤模型与骨髓模型在长期动态体外微生理系统(MPS)多器官串联芯片系统中的共培养成功实现。人骨髓间充质干细胞(BM-MSCs)预先在羟基磷灰石涂层的氧化锆基Sponceram®支架上培养7天,随后加入人源BM-CD34+细胞并转移至HUMIMIC Chip3plus三器官芯片。两周后,如示意图(A)所示,将三维长周期皮肤模型(Phenion®)接入芯片继续培养3周。(B)为HUMIMIC Chip3plus三器官芯片的俯视图,展示其组成结构包括皮肤模型、骨髓模型、通过芯片内置微流泵循环的培养液及再循环的骨髓来源细胞。(C)为共培养上清液中乳酸脱氢酶(LDH)释放量的检测结果。细胞毒性通过LDH释放百分比进行量化,该数值经诱导裂解后的皮肤模型和骨髓细胞最大LDH释放量标准化处理。(D)展示三维皮肤模型的苏SU木MU精-伊红染色(左)及免疫荧光染色(右)结果,检测胶原蛋白IV(Col IV,红色)、角蛋白14(Kr14,红色)和角蛋白10(Kr10,红色)的表达。图示为代表性图像,比例尺=100微米。(E)通过流式细胞术测定不同骨髓细胞亚群的比例。左图显示活细胞中各骨髓模型群体(祖细胞、单核细胞、粒细胞、血小板/巨核细胞及早期红系细胞)的百分比;右图则呈现各类祖细胞群在总祖细胞中的占比,包括造血干细胞(HSCs)、多能祖细胞(MPPs)、共同淋巴样祖细胞(CLPs)、共同髓样祖细胞(CMPs)、粒-单核祖细胞(GMPs)及巨核-红系祖细胞(MEPs)。数据以均值±标准误表示,来源于1项包含1-2次重复的实验。图(A)中HUMIMIC Chip3plus三器官芯片图像由TissUse GmbH提供,采用CC BY ND 4.0许可协议授权使用。
Skin and BM model show rejuvenated properties when exposed to young human serum皮肤与骨髓模型在接触年轻人体血清后呈现年轻化特征
成功建立动态串联共培养模型后,我们在由皮肤模型和骨髓模型(培养于添加生长因子的SFEM II培养基中)组成的动态串联共培养体系中,分别加入10%年轻人体或老年人体血清,以研究其对皮肤和骨髓衰老生物标志物的影响。
值得注意的是,与使用老年血清共培养的模型相比,采用年轻人体血清与骨髓模型共培养的动态皮肤模型中Ki67阳性细胞显著增加,表明组织再生能力得到提升(图3A)。此外,我们开发的皮肤特异性年龄时钟及血液年龄时钟均显示,与老年血清组相比,年轻人体血清与骨髓共培养的皮肤模型生物年龄显著降低(图3B)。相较于无血清培养条件,人血清的添加显著增强了皮肤模型的增殖能力,这很可能归因于血清中富含的生长因子(补充图3)。
Figure 3. The skin model and the BM model show rejuvenated properties when co-cultured with young human serum in a long term dynamic in vitro MPS. 在长期动态体外微生理系统(MPS)中与年轻人体血清共培养时,皮肤模型与骨髓模型均表现出年轻化特征。骨髓模型预先在HUMIMIC Chip3plus三器官芯片芯片中培养。培养两周后(培养第14天),将3D长周期皮肤模型(Phenion)接入系统,并分别使用年轻或老年人血清进行为期三周的共培养(培养第14-35天)。(A)三维皮肤模型Ki67免疫荧光染色(红色)结果,左侧展示代表性图像(比例尺=100微米),柱状图显示经老年人血清处理的Ki67阳性细胞相对比例。(B)采用皮肤DNA甲基化时钟[7]与血液年龄时钟[8]测定三维皮肤模型的DNA甲基化生物学年龄。(C)培养第17、24及31天获取的骨髓细胞线粒体膜电位,数据以老年人血清处理组为基准进行标准化。(D)骨髓细胞流式细胞术分析,柱状图分别显示培养14、21、28及35天后活骨髓细胞中祖细胞(左)、单核细胞(中)及粒细胞(右)的比例。数据来源于单次(A、C)或两次(B、D)独立实验(每组4-7个复孔),以均值±SEM(A、C、D)或均值±SD(B)表示。
在分析血清对骨髓源血细胞的影响时发现,使用年轻人体血清培养至35天时,祖细胞数量显著增多(图3D)。在此之前,整个共培养期间已可观察到年轻人体血清处理的微生理系统(MPS)中祖细胞比例呈现明显(虽未达显著性)的增高趋势。此外,年轻人体血清培养35天后粒细胞比例显著上升(图3D)。相比之下,在进一步分化的细胞中,年轻人体血清处理的骨髓样本单核细胞比例略有(但非显著)下降。
我们还将线粒体膜电位作为衰老的另一标志物进行检测。在第24天和31天,年轻人体血清培养的骨髓细胞膜电位显著增强(图3C)。
综上所述,本研究首次通过体外微生理系统证实:相较于老年人体血清,年轻人体血清在骨髓模型存在条件下对皮肤具有年轻化作用。同时,骨髓模型对年轻人体血清的响应表现为祖细胞显著增加、粒细胞显著减少以及线粒体膜电位改善。
The BM model produces age-relevant proteins when exposed to human serum BM模型在接触人血清后会产生与年龄相关的蛋白质
为鉴定BM模型响应人体血清所产生的、可能对皮肤模型具有年轻化效应的特定因子,我们采用基于LC-IMS-MS/MS的蛋白质组学分析技术。在使用年轻或老年人血清培养21天(培养第35天)后,采用PBS(−/−)冲洗BM细胞以确保蛋白质组学分析前完全去除所有生长因子和血清成分。总体而言,所有样本中约检测到6,000种不同蛋白质。其中9种蛋白质在年轻与老年人血清处理的BM样本中存在显著丰度差异,包括5种上调和4种下调蛋白(图4A)。根据人体蛋白质图谱数据库(proteinatlas.org)的"人体分泌蛋白组"清单,这些蛋白均未被报道具有潜在影响其他组织的分泌特性。
基于此,我们详细分析了在五分之四及以上样本中呈现相同调控趋势的所有蛋白质。若某种蛋白在5次重复实验中有4次呈现(老年vs年轻)一致的丰度变化趋势,则将其归类为潜在调控蛋白。据此标准共鉴定2,078种蛋白质,其中与年轻人血清培养相比,老年人血清培养的BM模型中1,033种蛋白下调、1,045种蛋白上调(图4A)。通过将该潜在调控蛋白组与人体蛋白质图谱记载的2,772种分泌蛋白进行比对,最终筛选出233种可能通过血液循环影响皮肤的检测蛋白(112种下调和121种上调,图4B)。
对差异分泌蛋白组进行的独立GO-Term富集分析显示:老年血清处理的BM模型中,112种下调蛋白显著富集于8条通路,包括与衰老相关的生物学过程"细胞死亡与凋亡"、"脂质代谢"及"免疫系统调控";而上调蛋白则显著富集于"应激反应"、"转运过程"及"甘油三酯代谢"等GO条目(图4C)。进一步分析发现,233种潜在调控分泌蛋白中有55种与既往研究报道的656种人体血浆年龄依赖性差异蛋白重叠(图4D、4E)。值得注意的是,26种潜在下调蛋白中有14种由粒细胞或祖细胞表达(据proteinatlas.org),这与老年人体血清处理后观察到的细胞群显著减少现象相符;而27种潜在上调重叠分泌蛋白中14种由单核细胞表达,其在老年人体血清培养后呈现增加趋势。
STRING网络分析显示:基于共表达、基因邻接或已知相互作用等证据,潜在下调与上调蛋白分别形成13个和16个互作网络节点(图4F)。其中鉴定出5个枢纽蛋白:MMP9与CD163(下调)以及APOB、CRP和SERPINE1(上调),这些蛋白至少与其他5种潜在标志蛋白存在相互作用关系。
综合上述分析,我们在骨髓分泌的蛋白质中鉴定出55种具有潜在抗衰老作用的年龄相关蛋白,这些蛋白可能引发所观察到的皮肤年轻化效应。
Age-relevant proteins rejuvenate skin tissue characteristics 与年龄相关的蛋白质可逆转皮肤衰老特征
鉴于骨髓分泌的年龄相关蛋白质经老年人体血清处理后表达下调,且可能具有皮肤再生作用,我们尝试验证其对多种衰老标志物的逆转能力。从26种已鉴定的下调蛋白中,基于可获得性、人体细胞生产能力以及包含祖细胞、粒细胞等骨髓细胞表达蛋白的标准,筛选出7种目标蛋白。实验采用从3至20位60岁以上供体分离的成纤维细胞或角质形成细胞,以100 ng/ml浓度处理72小时[31],并与未处理对照组进行比较。作为基准对照,我们同时评估了GDF-11(一种在体外及离体实验中具有皮肤再生作用的系统性因子)的处理效果。
Ki67阳性细胞分析显示,与空白对照相比,半胱氨酸蛋白酶抑制剂-F(CST7)、白细胞介素1受体拮抗剂(IL1RN)、补体衰变加速因子(CD55)、Kunitz型蛋白酶抑制剂1(SPINT1)、基质金属蛋白酶-9(MMP-9)、IgA受体Fc片段(FCAR)、几丁质酶-3样蛋白1(CHI3L1)及GDF-11处理均显著促进成纤维细胞增殖。
Figure 4. The BM model secretes age-associated proteins. BM模型分泌与年龄相关的蛋白质。该模型经过为期五周的静态培养后,在第二周分别使用年轻或老年人血清处理BM细胞。培养第35天收集BM细胞,洗涤后的细胞沉淀物采用串联LC-IMS-MS/MS蛋白质组学技术进行分析。(A)与年轻血清相比,老年人血清处理的BM细胞中所有显著(p < 0.05)上调(橙色)或下调(青绿色)蛋白质的Log2FC与−log2(p值)分布图。图中同时标注了在5个样本中至少有4个呈现同向调控的蛋白质,其中红色表示上调,蓝色表示下调。(B)将全部调控蛋白质与人体蛋白质图谱数据库中的2772种潜在分泌蛋白进行比对,获得233个重叠蛋白。(C)对(B)图中所示重叠蛋白进行基因本体(Go-Term)功能富集分析,左图为下调蛋白,右图为上调蛋白。(D)热图显示(E)中55个重叠蛋白的Log2FC值,其中红色标记为老年人血清组上调蛋白,蓝色为下调蛋白。(E)韦恩图展示人体分泌组蛋白(左)与衰老过程中显著改变的分泌蛋白(右)的交集,最终确定55个共有的蛋白质。(F)基于STRING数据库构建(E)中55个重叠蛋白的调控网络,左图为下调蛋白,右图为上调蛋白。不同BM细胞类型的表达特征通过黄色圆圈(粒细胞)、蓝色圆圈(祖细胞)和紫色圆圈(单核细胞)加以标注。所有数据均来自含5次重复的独立实验。
在角质形成细胞中,仅CST7和GDF-11表现出促增殖效应(图5A及附表2)。采用前述衰老标志物检测体系发现,除FCAR外,新鉴定的蛋白质处理可显著改变DPT、DCN、THBS1、TAGLN等3-17个基因的表达差异(图5B)。此外,处理组成纤维细胞上清液中,CST7、CD55、SPINT1、CHI3L1和GDF-11显著增加前胶原蛋白1的分泌(图5E及附表2),而CD55、MMP9和CHI3L1处理则显著提升透明质酸水平(图5C及附表2)。为评估衰老的综合性标志,我们通过检测成纤维细胞向脂肪样细胞转分化能力来反映其部分重编程为高可塑性表型的程度[32]。经前脂肪细胞生长培养基培养两周后,所有七种蛋白处理组均显著提高脂肪样细胞比例(图5D及附表2)。线粒体膜电位检测显示,IL1RN、MMP-9和CHI3L1处理可显著改善该指标(图5F及附表2)。
综上,本研究证实六种蛋白质能在人体真皮成纤维细胞中改善两种以上衰老标志物,这支持了年轻人体血清通过骨髓源性细胞介导皮肤再生的潜在作用机制。
讨论
异种共生机体实验及血浆转移研究已证实,啮齿类动物体内存在的蛋白质或外泌体等血液因子对衰老器官组织具有再生作用,但人体组织所受影响及其关键因子的认知仍极为有限。本研究首次通过体外实验证实,含有多种系统性因子的年轻人体血清可促进人体皮肤的年轻化进程。值得注意的是,我们的研究首次提供了证据,表明系统性因子仅在骨髓源细胞存在时才能发挥皮肤再生效应。我们推测在本实验体系中,这些细胞通过响应年轻人体血清将系统性因子的浓度提升至有效水平,从而影响皮肤细胞。然而,有关骨髓源细胞在此过程中的具体作用机制仍需进一步研究。我们将系统性因子的骨髓依赖性再生效应归因于骨髓分泌蛋白,这一过程可能由骨髓亚群对年轻人体血清的响应性改变所驱动。需特别说明的是,本实验体系需依赖多种生长因子以建立可行的骨髓模型。虽然这些生长因子理论上亦可改善皮肤特性,但在对比含生长因子与年轻血清的培养组与含生长因子与老年血清的培养组时,其效应可忽略不计。本研究为未来应用系统性因子逆转人体皮肤衰老表征的治疗策略奠定了基础。
通过包含人体骨髓与皮肤模型的体外串联共培养系统,我们观测到年轻人体血清引发的皮肤年轻化现象,具体表现为细胞增殖率提升及生物学年龄降低——后者是综合评价组织再生的指标。增殖细胞减少是衰老的核心特征之一,而增殖标志物Ki67的减少在衰老人体皮肤中也已被证实。既往研究显示衰老动物血清会导致体外培养细胞增殖减弱,但采用不同血清类型或细胞系的其他研究未能复现该现象。本研究中,人体血清的添加导致皮肤模型细胞增殖增强(附图3),且年轻血清的促增殖效应显著强于老年血清,提示除已鉴定的年龄相关蛋白外,年轻生长因子可能具有额外的再生作用。基于DNA甲基化模式评估生物学年龄的表观遗传时钟,已成为目前最具前景且广泛应用的衰老综合评价工具。现有报道显示异种共生后血液与肝脏等组织的生物学年龄显著降低,但皮肤尚未见类似记载。
本体外实验表明,皮肤的再生依赖于循环系统中骨髓源血细胞的存在。早期研究认为衰老造血干细胞(HSCs)对系统性年轻化干预无响应,但该研究未考察其他祖细胞及其衍生细胞。与之相反,新近研究发现HSCs及其他骨髓祖细胞是小鼠体系中对年轻血液最敏感的细胞类型,支持其对再生过程的重要影响。另有研究报道系统性释放因子可促进HSCs增殖并维持其静息状态。在本研究的人体骨髓模型中,我们观察到多项指示年轻血清再生效应的变化:年轻血清显著增加祖细胞群比例——这与HSCs自我更新能力随衰老减弱的特性相符;老年血清培养后粒细胞群减少的现象也与衰老人体血细胞特征一致[20];单核细胞群在老年血清培养后的增加趋势亦符合人体衰老过程中的变化规律。此外,通过检测年轻血清培养后骨髓模型线粒体膜电位的改善,我们证实年轻血清能重塑骨髓的年轻化特征。线粒体功能损伤导致活性氧增加、炎症反应及细胞死亡,已被确定为衰老的拮抗性特征。
Figure 5. Age-associated proteins secreted by the young BM model rejuvenate skin cells. 年轻骨髓模型分泌的年龄相关蛋白可促进皮肤细胞年轻化。实验对老年(>60岁)原代人真皮成纤维细胞及老年(>60岁)原代人表皮角质形成细胞进行静态培养,并采用100 ng/ml特定下调年龄相关蛋白处理72小时。(A)成纤维细胞(上)与角质形成细胞(下)Ki67免疫荧光染色结果。柱状图显示Ki67阳性细胞比例经未处理对照组标准化后的相对值,n = 5-20。(B)热图展示经蛋白处理的静态培养成纤维细胞相对于未处理对照组的基因表达差异,n = 4。(C)柱状图显示成纤维细胞上清液中透明质酸产量经未处理对照组标准化后的相对值,n = 3-7。(D)柱状图展示经蛋白处理的成纤维细胞向脂肪样细胞分化的相对能力(以无蛋白培养对照组为基准),n = 7-14。(E)柱状图呈现成纤维细胞上清液中I型前胶原产量经未处理对照组标准化后的相对值,n = 3-7。(F)柱状图显示处理组成纤维细胞线粒体膜电位相对于未处理对照组的相对变化,n = 6-10。数据以均值±标准误表示
鉴于本实验设计中,皮肤仅在骨髓细胞存在条件下实现再生,我们通过骨髓蛋白质组学分析对相关蛋白进行了系统研究。
经鉴定,55种潜在分泌蛋白在血清处理条件下呈现骨髓特异性差异表达,且已有文献[28-30]证实这些蛋白在人体衰老血清中会发生改变。其中7种蛋白通过至少两项衰老标志物检测指标的改善,被证实具有 rejuvenating effects(再生效应)。尽管既往研究报道了人体衰老血清中存在诸多系统性变化因子,但仅有少数蛋白被证实参与系统性再生过程,且其效应主要在针对肌肉、大脑、心脏和肝脏等器官的啮齿类动物实验中获得验证。据我们所知,GDF-11是目前唯WEI一被报道能通过调控祖细胞增殖、抑制炎症反应及改善细胞外基质结构来改善人体皮肤衰老特征的因子。
在体外对成纤维细胞具有再生效应的7种蛋白中,CHI3L1在所有六项衰老标志物检测中均显示改善效果,包括:增殖能力增强、衰老相关基因表达改变、I型前胶原和透明质酸合成增加、成纤维细胞向脂肪样细胞分化能力提升以及线粒体膜电位升高。相较于已被确认为皮肤再生因子的GDF-11(本研究将其作为基准对照),CHI3L1展现出更全面的衰老标志改善效应。已知CHI3L1通过抗凋亡保护、促进细胞分裂、协助组织重塑以及介导包含修复机制在内的炎症反应信号传导来增强细胞存活率,这与我们观察到的其对多重皮肤衰老标志物的调控作用相一致。迄今为止,其效应仅在大脑和肺组织中被报道。CD55和MMP-9在五项衰老标志检测中表现改善。MMP-9已知可诱导SCF生成从而募集祖细胞,这为本研究中观察到的年轻人体血清处理后祖细胞增加现象提供了潜在解释。此外,基质金属蛋白酶在皮肤再生和表皮分化过程中起关键作用。作为补体衰变加速因子,CD55通过抑制补体激活,可能拮抗与衰老相关的炎症水平升高(即"炎性衰老"),包括皮肤衰老过程中补体水平的异常增高。同样各改善三项衰老标志的IL1RN和FCAR均为免疫调节因子,可能通过缓解"炎性衰老"发挥再生作用。虽然FCAR在衰老中的角色尚不明确,但已知升高的IL-1水平会促进皮肤炎性衰老,而作为IL-1受体拮抗剂的IL1RN可能补偿这一过程。蛋白酶抑制剂CST7和SPINT1均对增殖、基因表达、转分化能力和I型前胶原合成这四项衰老标志产生改善。这两种蛋白已知参与细胞衰老及胶原/弹性蛋白降解过程,提示了其作用于皮肤细胞的潜在再生机制。值得注意的是,它们均由粒细胞分泌(其中SPINT1主要来源于祖细胞),而这两类细胞正是我们实验中添加年轻人体血清后骨髓细胞内显著增加的群体。
需要特别说明的是,本研究特意采用二维细胞培养体系来解析各因子对单一细胞类型的特异性效应,这种方法有助于阐明在复杂三维皮肤模型中可能被掩盖的细胞机制与应答。通过二维培养系统,我们得以全面探索皮肤衰老的多重标志特征,并识别参与核心生物学过程的关键信号通路与分子互作网络,而早期基因表达响应同样具有研究价值,需后续深入探索。本研究主要着眼于鉴定可能促进人体皮肤再生的关键衰老相关蛋白,但鉴于多项实验已证实衰老血清对细胞功能的负面影响[36],未来研究应着重解析骨髓来源细胞的衰老分泌组,以阐明衰老血清对皮肤细胞产生有害效应的因果机制及关键调控因子。
综上所述,利用包含骨髓与皮肤的体外微生理系统(MPS),我们成功复现了血液循环因子对人体皮肤的系统性再生效应——该现象此前仅在啮齿类异时共生实验中得证。更重要的是,我们在该系统中鉴定出多个可能介导皮肤再生的关键蛋白。然而系统性因子不仅包含蛋白质,还涉及外泌体、代谢物和microRNA等成分。后续研究需在系统性皮肤再生与衰老背景下进一步验证已鉴定蛋白,例如采用衰老细胞构建三维皮肤模型或延长培养周期等实验设计将极具探索价值。此外,结合肾脏等重要过滤器官(其在系统性衰老中扮演关键角色)来探究皮肤与其他器官的协同再生机制也将成为有趣的研究方向。
方法
Skin model culture
Phenion®全层插入式皮肤模型采用气液界面培养法(Phenion公司,德国),在37℃、5% CO2条件下,于Transwell培养系统中进行培养。培养体系补充了10%的人源年轻供体(10名30岁以下供体混合)或老年供体(10名60岁以上供体混合)血清(Zen-Bio公司,附表3)。静态培养期间每日更换培养基,持续培养7天。在HUMIMIC Chip3plus类器官串联芯片培养系统(TissUse GmbH公司)中,微流道填充2 mL新鲜培养基,皮肤模型置于芯片中央24孔室。随后将系统连接至HUMIMIC Starter控制单元,在500 mbar正负压条件下以0.5 Hz泵频运行。动态培养期间每日更换半量培养基,持续培养21天。本研究选用标准Phenion®皮肤模型而非衰老模型,旨在避免药物诱导衰老过程可能导致的皮肤细胞非生理性反应,同时提高识别衰老可见征兆前早期变化的研究效能。
BM culture
BM模型的构建与培养方法参照先前文献所述。具体而言,将50万株预培养的人骨髓间充质干细胞(Lonza Group AG)接种于羟基磷灰石包被的氧化锆基Sponceram®圆柱体支架(TissUse GmbH)上。采用含10%胎牛血清、1%青霉素/链霉素及1% GlutaMAX(均购自Thermo Fisher Scientific)的高糖DMEM培养基(Gibco)培养7天后,向系统中加入1万个人骨髓CD34+细胞(Lonza Group AG),并将培养基更换为StemSpan™ SFEM II(Stemcell Technologies)基础培养基,补充50 ng/mL SCF、10 ng/mL TPO、100 ng/mL Flt3-L(均源于Peprotech)及1%青霉素/链霉素。次日晨,将培养的Sponceram®圆柱体转移至24孔板中,并实施每2-3天的培养基更换。
在HUMIMIC Chip3plus类器官串联芯片培养系统进行动态培养时,将预孵育的支架转移至96孔培养舱。灌注回路中注入2 mL新鲜培养基后,将系统与HUMIMIC Starter控制单元连接,并按前述方法运行HUMIMIC Chip3plus三器官芯片。前两周期间,每周实施两次1.6 mL培养基置换。每周一次的培养基更换过程中,通过重悬法采集骨髓细胞样本用于后续流式细胞术分析。
Co-culture of the BM and skin model within the HUMIMIC Chip3plus
在动态BM模型培养14天后,将Phenion®全厚度长寿命插入式皮肤模型置于HUMIMIC Chip3plus三器官芯片的24孔小室,并将培养基更换为StemSpan™ SFEM II(Stemcell Technologies公司产品)补充50 ng/mL SCF、10 ng/mL TPO、100 ng/mL Flt3-L、1 ng/mL M-CSF、1 ng/mL GM-CSF(均购自Peprotech公司)、1%青霉素-链霉素(Thermo Fisher Scientific公司产品)以及10%年轻或老年供体的人血清。共培养系统维持21天,每日更换0.6 mL培养基。每周收集一次骨髓细胞,采用流式细胞术进行分析。
共培养3周后,从HUMIMIC Chip3plus三器官芯片中取出皮肤模型并剖半进行后续检测。用于组织学分析的部分皮肤模型直接包埋于Tissue-Tek®(Sakura Fintek公司产品)中液氮速冻。针对RNA与DNA分析,使用精细镊子分离表皮层与真皮层,分别于液氮中冷冻保存。
Flow cytometry
从HUMIMIC Chip3plus三器官芯片中提取的骨髓单细胞悬液经Fc受体阻断剂(1:12.5,Miltenyi Biotech)重悬后,冰上孵育5分钟。随后加入以下荧光抗体的不同组合(1:50稀释),避光条件下冰浴孵育20分钟:抗CD123-PE、CD15-PE-Cy7、CD38-PerCP-Cy5.5、CD45RA-BV421、CD16-APC、CD14-BV711、CD34-APC-Cy7、CD13-BV711、CD41-PE-Cy7、CD71-PerCP-Cy5.5、CD36-BV421、CD235a-APC及CD229-PE抗体(均购自BioLegend公司,详见附表4)。采用Zombie Green荧光活性染料(BioLegend)按说明书操作进行死细胞鉴别。使用BD LSRFortessa™流式细胞仪(BD Biosciences)进行检测,实验数据通过FlowJo v10.7.1软件进行分析。
nCounter XT gene expression analysis
冷冻的真皮和表皮样本在350微升RLT裂解缓冲液(Qiagen)中解冻后,加入1% β-巯基乙醇(Sigma-Aldrich),采用陶瓷珠和Precellys 24均质仪(Bertin Technologies)进行组织匀浆处理。随后按照操作规范,使用RNeasy® Mini Kit(Qiagen)和QiaCube Connect(Qiagen)完成RNA提取。基因表达分析采用70纳克RNA样本,与特异性靶标报告探针和捕获探针在65℃下杂交24小时。样本检测使用nCounter SPRINT分析系统(Bruker),并通过nSolver软件进行数据分析。数据标准化处理以对照样本及以下看家基因为参照:GAPDH、GUSB、OAZ1、PUM1和UBC。
Immunofluorescence staining
针对每种皮肤模型,取四份间距为5微米的冷冻切片样本,采用4%甲醛(默克公司)固定后,以3%牛血清白蛋白(美天旎生物技术)封闭,并加入0.05% Tween® 20(西格玛奥德里奇)进行透化处理。样本与一抗(Ki67、IV型胶原蛋白、角蛋白10或角蛋白14,稀释比例1:300,艾博抗公司,详见附表5)孵育过夜后,加入荧光染料标记的二抗(稀释比例1:1000,Invitrogen,Alexa Fluor 546标记的山羊抗小鼠IgG),最后使用含DNA荧光染料DAPI的ProLong™ Gold抗淬灭封片剂(英维特rogen公司)进行封片。所有成像均通过基恩士BZ-X810荧光显微镜完成,并对各间距切片采用ImageJ软件进行系统分析[51]。为计算Ki67阳性细胞相对数量,经处理的皮肤模型中Ki67阳性细胞百分比均以老年人血清处理的全部皮肤模型数据为基准进行标准化处理。
DNA methylation analysis
针对每个皮肤模型,取四份间距5微米的冷冻切片样本,采用4%甲醛(默克公司)固定,3%牛血清白蛋白(美天旎生物)封闭,0.05% Tween® 20(西格玛奥德里奇)透化处理。样本与一抗(Ki67、IV型胶原、角蛋白10或角蛋白14,1:300稀释,艾博抗公司,附表5)4℃孵育过夜后,加入荧光标记二抗(1:1000稀释,英杰公司,Alexa Fluor 546标记山羊抗小鼠IgG),采用含DNA染料DAPI的ProLong™ Gold抗荧光淬灭封片剂(英杰公司)封片。所有图像通过基恩士BZ-X810显微镜采集,间距切片数据均采用ImageJ软件[51]分析。为计算Ki67阳性细胞相对值,处理组皮肤模型的Ki67阳性细胞百分比均以老年人血清处理的所有皮肤模型数据为基准进行标准化。
冷冻皮肤模型样本在PBS(−/−)中解冻后,使用Precellys 24组织匀浆仪(伯坦科技)配合陶瓷珠进行匀浆处理。DNA提取采用QIAamp DNA Investigator试剂盒(凯杰公司),严格遵循制造商标准流程。DNA定量通过Pico green荧光检测试剂盒(赛默飞世尔科技)完成,随后使用Infinium MethylationEPIC v2.0甲基化芯片(Illumina公司)检测约935,000个CpG位点。甲基化数据分析采用R语言minfi包(v1.48.0)完成,具体流程包括:加载原始.idat文件、数据过滤、预处理及默认参数下的分位数归一化。
表观遗传年龄时钟是基于人工智能开发的预测模型,通过训练多组甲基化数据集来评估生物年龄。本研究采用经378例皮肤样本训练的皮肤DNA甲基化时钟模型[7]和656例血液样本训练的血液年龄时钟模型,将实验获得的分位数归一化甲基化数据作为输入值,测算皮肤模型的生物年龄。现有研究证实表观遗传年龄时钟适用于体内外实验体系,这为本实验设计中采用该技术评估不同培养条件下的相对变化提供了理论依据。
LC-IMS-MS/MS proteomics
采用年轻或老年人体血清培养的BM模型所产蛋白质经以下流程进行分析:取50,000个细胞制备裂解液,使用8M硫LIU脲缓冲液处理,通过Invitrogen™ Qubit™蛋白质定量试剂盒测定蛋白浓度,随后参照滤膜辅助样本制备方案[54]完成蛋白质酶解及多肽纯化流程,包括还原、烷基化处理以及rLys-C与胰蛋白酶的双酶切步骤。脱盐后的多肽经真空浓缩后重悬于0.1%甲酸溶液以待分析。通过纳升级超高效液相色谱(nano-uHPLC)分离400ng多肽样品,并在经py_diAID优化的timsTOF Pro 2质谱仪上采用数据非依赖采集-并行累积连续碎裂(DIA-PASEF)模式进行检测。原始数据通过DIA-NN(1.8.1版)[56]结合人体参考蛋白质组进行无文库分析,采用DESeq2(显著性阈值设定为校正p值<0.05)鉴定差异表达蛋白。数据可视化通过R语言dplyr及ComplexHeatmap等程序包完成。
北京佰司特科技有限责任公司
类器官串联芯片培养系统—HUMIMIC;类器官灌流式培养和代谢监测系统—IMOLA;
蛋白稳定性分析仪—PSA-16;单分子稳定性分析仪(磁镊力谱测量仪)—HiMT;单分子质量光度计—TwoMP;超高速视频级原子力显微镜—HS-AFM;微流控扩散测量仪—Fluidity One-M;
微纳加工点印仪—NLP2000/DPN5000;台式原子力显微镜—ACST-AFM;全自动半导体式细胞计数仪—SOL COUNT;农药残留定量检测仪—BST-100;